



手机为什么用久了,每天掉电很快,需要频繁充电?
这些都是由于我们手机电池自身的特点造成的。手机因为受到质量和体积的限制,电池体积被压缩得很小,电极材料质量有限,所能携带的电量仅能满足一天左右的需求,所以需要每天充电。而随着电池使用次数的增加,电池电极材料逐渐失去活性,电池所能放出的容量逐渐减少,所以用久了,一天可能得充电好多次。
钴酸锂
手机电池一般所采用的是锂离子电池。锂离子电池中最常用的正极材料是钴酸锂、锰酸锂、磷酸铁锂和镍钴锰三元材料。其中,钴酸锂具有较高的理论容量,达到274mAh/g,实际应用中的容量达到140-180mAh/g。同时,钴酸锂的压实密度在众多正极材料中最高,达到4.2g/cm3。压实密度越大,同等质量下所制成的电池体积越小,也更方便携带,所以在手机中一般使用的都是钴酸锂正极材料。

钴酸锂用作锂离子电池最早是由诺贝尔奖得主古迪纳夫教授(Prof. Goodenough)提出的,它是历史上第一个商业化的锂离子电池正极材料,由索尼公司在1991年商业化生产。它的开路电压为3.6V,工作电压达到4.2V,能量密度较高。且钴酸锂循环性能稳定,工作温度区间较宽(-20~55℃),可以适应多种环境。
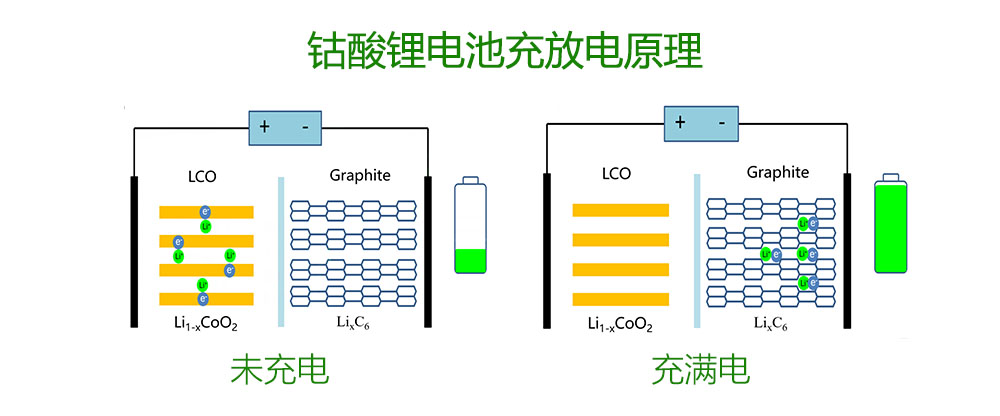
上图展示了锂离子电池的工作原理。其中正极材料为钴酸锂LCO,负极材料为石墨。隔膜和电解质既实现了两个电极之间锂离子的传导,又让他们不能够直接导通,使得电流只能在外部从正极流向负极。在充电过程中,锂离子从钴酸锂阴极析出,穿过隔膜和电解液,嵌入石墨阳极。在放电过程中,锂离子从负极石墨返回到正极钴酸锂。
可见,锂离子电池的充放电循环是通过两个电极之间锂离子的嵌入和脱出来实现的。所以,如果想要增加一个锂离子电池的容量,我们只需要使用更多的锂离子就可以了。为了释放钴酸锂中更多的锂离子,我们需要提高它的充电电压,准确来说是提高截止电压。
钴酸锂结构
但是,钴酸锂电池的截止电压也不能无限制的提高。我们在这里遇到了一个问题,钴酸锂具有非常高的理论比容量,达到274mAh/g,截止电压极限在4.75V以上。但是在正常情况下,我们只能发挥其中一半的锂容量,一般在140mAh/g左右,截止电压也限制在了4.2V。为什么明明具有这么高的理论容量,但是却不能发挥呢?
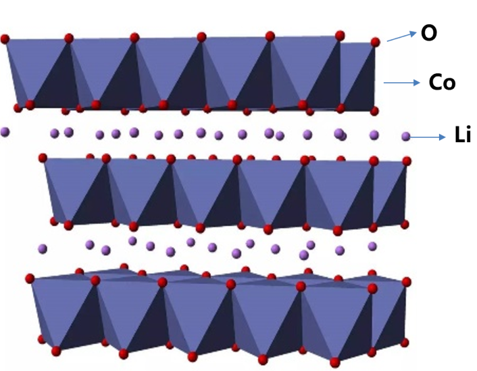
钴酸锂晶体结构
这是因为钴酸锂具有层状的晶体结构,如果脱出太多的锂离子,晶体就会相变。钴酸锂的晶体结构就像一个汉堡。钴原子和氧原子以共价键结合,形成八面体的结构。我们称其为共价致密层(也称寄主晶体层)。而锂元素在两个钴氧层之间(也称晶间层)。在合适的电压下,锂离子在层间可以轻松的嵌入和脱出,具有良好的离子迁移能力。同时,锂离子在晶格中,支撑着上下的钴氧层。带正电的锂离子通过静电引力将两个带负电的氧层结合在一起。
所以,当我们需要在钴酸锂电池中使用更多的锂离子时,就意味着有更多的锂离子从钴酸锂层状的晶体中脱出,能够粘附在钴氧层上的锂离子将会减少。在某些关键的节点,锂离子脱出达到了一定的程度,钴氧层之间锂离子太少了,整个晶体会发生不可逆的相变,会对电池的循环造成严重的影响,用不了几次,电池就损坏了。
所以,我们需要让部分锂离子保持在它们原来的晶格位置。而发挥一半的理论容量,对钴酸锂电池来说是一个相对稳定的状态,既能够发挥比较多的容量,也能保证多次循环后电池容量损失较小。这时的截止电压为4.2V,容量为140mAh/g。
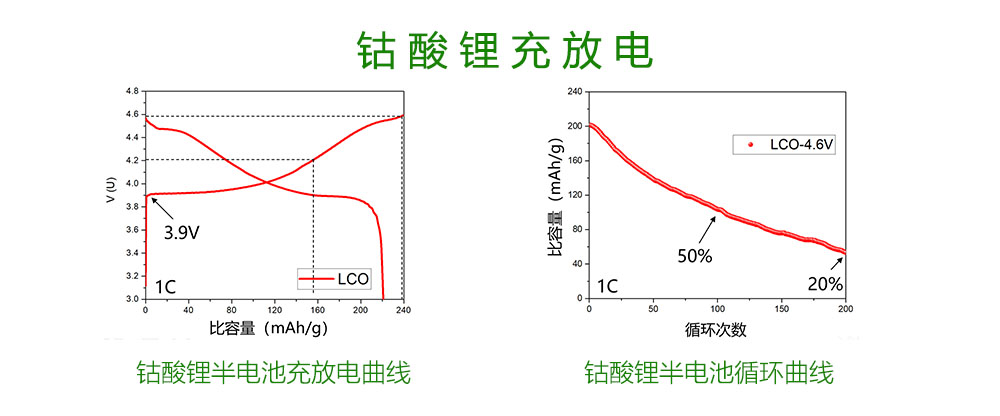
为了更好的说明钴酸锂的在充放电过程中的变化,我们以钴酸锂半电池为研究对象。上图展示的是钴酸锂半电池的充放电曲线。半电池的意思是以金属锂作为负极,金属锂具有最低的氧化还原电位,而且在锂离子电池中是一个富锂的电极,电池研究中常常以锂片来制成电池负极,来研究其他正极材料。
我们可以看到钴酸锂具有非常高的电压平台,大概从3.9V开始,一直到充电截止。而这样高的电压平台,在应用中也有很多好处。电池的能量密度与电压平台成平方关系,相同容量高电压平台会使得能量密度高出很多。对于手机来说,不需要设计复杂的电路来稳定电压,就能够获得一个很高的输出电压,电量的使用效率更高。同时电池的输出功率更高,能够应用在更大功率的器件上。
当这个电池充电至4.2V时,可逆放出的容量大约140mAh/g;当充电至4.6V时,放出容量约为220mAh/g。但是当钴酸锂以4.6V高压充放电时,电池的容量会随着循环次数的增加而急剧下降。在1C情况下,100次循环后仅剩下50%容量;而200次循环后,仅剩下20%。想象一下,假设每天都给手机充电,你的手机电池容量在你买了半年后,每天得充四五次电才能维持,那实在是太难以忍受了。
钴酸锂研究进展
为了提高钴酸锂的截止电压,提高电池的使用容量,同时保证电池长循环的稳定性,我们需要对钴酸锂进行适当的修饰。
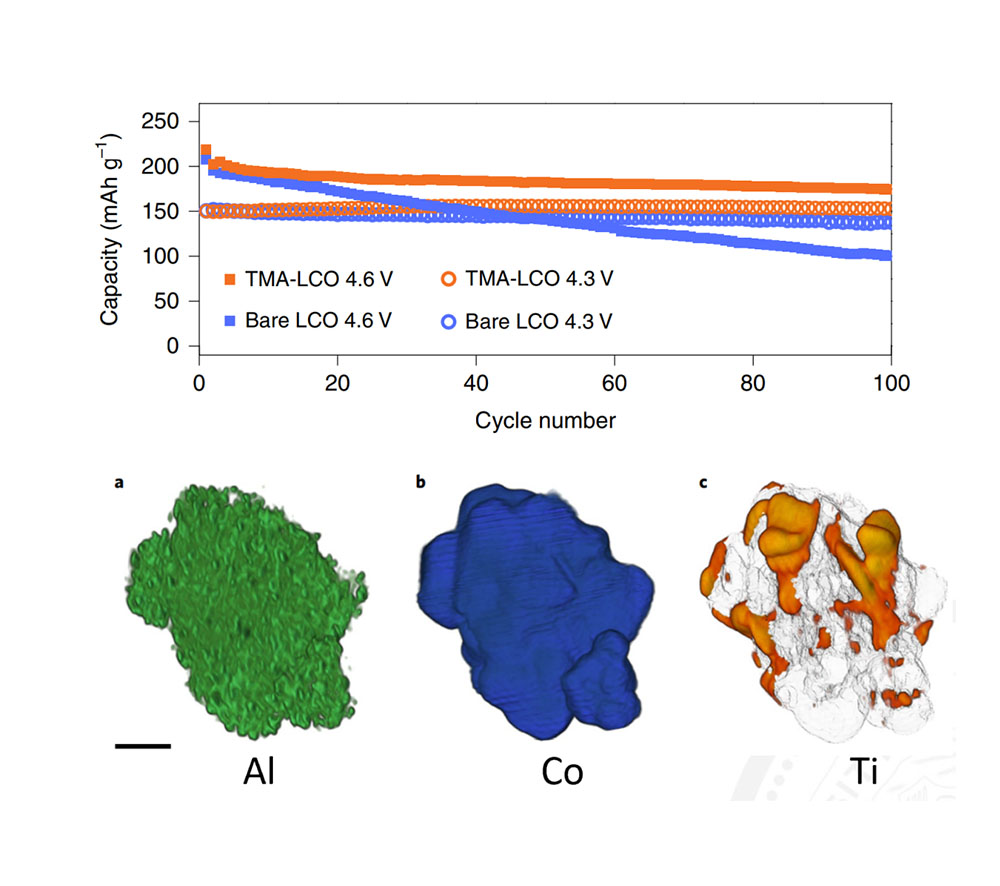
上图展示了一项代表性的研究工作,研究人员在合成钴酸锂时,加入氧化镁(MgO),氧化铝(Al2O3)和二氧化钛(TiO2)。镁元素和铝元素掺杂进入了钴酸锂的晶格中,像支柱一样撑起晶格,抑制了钴酸锂在高压下的有害相变。而钛元素主要聚集在在晶界和钴酸锂晶体颗粒表面上,改变了晶粒的微观结构,同时在高电压下稳定了表面的氧原子。这两种方法协同提高了钴酸锂在高压下的循环稳定性,4.6V下100次循环能达到87%。
总结
然而,钴酸锂也有一些缺点。
首先,钴元素价格很高,而且大多数是在非洲刚果地区生产。其次,钴元素储量不足,而且矿产供应不稳定,尤其是相对于磷酸铁锂、富镍正极材料等,钴的储量无法满足人类的需求。
目前我们有镍钴锰三元材料,它具有和钴酸锂一样的层状晶体结构,应用容量可达180mAh/g以上,但是,这些还不足以取代钴酸锂,因为钴酸锂最突出的压实密度高的特点,可以实现更小体积电池的制备。而且,钴酸锂在众多正极材料中具有最高的电压平台,这意味着更高的能量密度,与更高的电量使用效率,这对消费电子行业很重要。
最后,希望在未来,我们可以使用4.6V甚至更高截止电压的钴酸锂电池,我们的手机可以很长时间不用充电,而且电池寿命也更长。
参考文献
[1] Huang Y, Zhu Y, Fu H, et al. Mg‐pillared LiCoO2: Towards Stable Cycling at 4.6 V[J]. Angewandte Chemie, 2020.
[2] Canis B. Unmanned aircraft systems (UAS): Commercial outlook for a new industry[J]. 2015.
[3] Kalluri S, Yoon M, Jo M, et al. Feasibility of cathode surface coating technology for high‐energy lithium‐ion and beyond‐lithium‐ion batteries[J]. Advanced materials, 2017, 29(48): 1605807.
[4] Li Y, Yu H, Hu Y, et al. Surface-engineering of layered LiNi0. 815Co0. 15Al0. 035O2 cathode material for high-energy and stable Li-ion batteries[J]. Journal of energy chemistry, 2018, 27(2): 559-564.
[5] Wang L, Chen B, Ma J, et al. Reviving lithium cobalt oxide-based lithium secondary batteries-toward a higher energy density[J]. Chemical Society Reviews, 2018, 47(17): 6505-6602.
[6] Gu R, Cheng T, Ma Z, et al. Enhanced cycling stability of high voltage LiCoO2 by surface phosphorylation[J]. Journal of Alloys and Compounds, 2019, 803: 348-353.
[7] Qin C, Jiang Y, Yan P, et al. Revealing the minor Li-ion blocking effect of LiCoO2 surface phase transition layer[J]. Journal of Power Sources, 2020, 460: 228126.
[8] Manthiram A. An outlook on lithium ion battery technology. ACS Central Sci 3: 1063–1069[J]. 2017.
[9] Huang Y, Zhu Y, Fu H, et al. Mg‐pillared LiCoO2: Towards Stable Cycling at 4.6 V[J]. Angewandte Chemie, 2020.
[10] Zhang J N, Li Q, Ouyang C, et al. Trace doping of multiple elements enables stable battery cycling of LiCoO2 at 4.6 V[J]. Nature Energy, 2019, 4(7): 594-603.
[11] Liang J, Wu D, Hu M, et al. Could Li/Ni disorder be utilized positively? Combined experimental and computational investigation on pillar effect of Ni at Li sites on LiCoO2 at high voltages[J]. Electrochimica Acta, 2014, 146: 784-791.
[12] He Huang et al. Adv. Energy Mater. 2021, 2101864